肺高血圧症治療ガイドライン(2012年改訂版)
Guidelines for Treatment of Pulmonary Hypertension(JCS2012)
Guidelines for Treatment of Pulmonary Hypertension(JCS2012)
慢性肝疾患の有無に関わらず門脈圧亢進症を認める
安静時平均肺動脈圧(mPAP)>25mmHg
平均肺動脈楔入圧(mPCWP)<15mmHg
肺血管抵抗(PVR)>240dyne/sec/cm2
安静時平均肺動脈圧(mPAP)>25mmHg
平均肺動脈楔入圧(mPCWP)<15mmHg
肺血管抵抗(PVR)>240dyne/sec/cm2
Class Ⅰ
1. 肝疾患を有する,もしくは肝移植の適応のある有症状
患者において,肺高血圧症の有無を検索する目的で心
エコーによるスクリーニングを行う (Level B)
Class Ⅱa
1. 門脈圧亢進症に関連するPAHでは合併症を考慮しなが
ら,IPAH患者と同じ治療アルゴリズムで治療を行う
(Level C)
Class Ⅲ
1.抗凝固療法 (Level C)
2.平均肺動脈圧35mmHg以上かつ/または肺
血管抵抗 250 dyne・sec・cm-5以下の有意
なPAHへの肝移植 (Level C)
1. 肝疾患を有する,もしくは肝移植の適応のある有症状
患者において,肺高血圧症の有無を検索する目的で心
エコーによるスクリーニングを行う (Level B)
Class Ⅱa
1. 門脈圧亢進症に関連するPAHでは合併症を考慮しなが
ら,IPAH患者と同じ治療アルゴリズムで治療を行う
(Level C)
Class Ⅲ
1.抗凝固療法 (Level C)
2.平均肺動脈圧35mmHg以上かつ/または肺
血管抵抗 250 dyne・sec・cm-5以下の有意
なPAHへの肝移植 (Level C)
因子正常軽症中等症重症
WHOクラスⅠ,Ⅱ Ⅱ,Ⅲ Ⅲ,Ⅳ
mPAP(mmHg) 15-24 25-34 35-44 >45
Cl(L/min-1/m2) 2.5-4 >2.5 2.0-2.5 <2.0
PVR(dynes/s cm-3) <240 240-500 500-800 >800
RAP(mmHg) 0-5 0-5 5-10 >10
予後良良~不良不良
特殊治療不要不要~必要必要
肝移植後の改善有有~無無
WHOクラスⅠ,Ⅱ Ⅱ,Ⅲ Ⅲ,Ⅳ
mPAP(mmHg) 15-24 25-34 35-44 >45
Cl(L/min-1/m2) 2.5-4 >2.5 2.0-2.5 <2.0
PVR(dynes/s cm-3) <240 240-500 500-800 >800
RAP(mmHg) 0-5 0-5 5-10 >10
予後良良~不良不良
特殊治療不要不要~必要必要
肝移植後の改善有有~無無
3 門脈圧亢進症に伴う肺動脈性肺高血圧症
要旨
門脈圧亢進症に伴うPAHは, 門脈肺高血圧症:portopulmonary hypertension( POPH) として知られている18),159).これは進行した肝疾患の既往の有無にかかわらず, 門脈圧亢進症に伴う肺高血圧症のことを指す17),160).POPHの病態生理はまだ十分に解明されていないが,進行したPOPHの肺動脈病変はIPAH のそれと類似している.有意なPOPHを有する肝疾患患者の予後は不良であるが,PAHに対する特異的治療薬がPOPH患者の予後を改善する報告もある.肺高血圧を有する肝移植患者も,その予後は不良であるため,肺動脈平均圧を35mmHg未満に低下させることが必要である.
①疫学,成因
最近のフランスの研究から,POPHはPAHの中で,IPAH,結合組織病に伴う肺高血圧症,先天性心疾患に伴うPAHに次いで,4 番目に多いと報告されており12),
門脈圧亢進症患者の2~6%にPOPHを有すると報告されている17),160)-162).POPHの成因はIPAHと異なり,まずシャントの出現や全身血管の拡張により高心拍出状態となるため,最初は肺血管抵抗が正常である.その後,肺血管へのshear stress が増加し,肺動脈内膜肥厚・肺動脈のリモデリングを生じ,肺動脈の閉塞・狭窄を来たし,肺血管抵抗が増加,さらにその部位に微小血栓が生じることでPOPHを生じると考えられている.進行するとPOPHの組織所見では血管内膜および中膜平滑筋の肥厚,血管内腔の叢状病変,壊死性血管炎やフィブリノイド壊死,微小血栓などを認める.また,肝疾患によるシャントの形成,肝代謝の低下により腸肝循環の代謝物質(セロトニンなど)が肺循環に流入することにより,肺の血管を収縮させ肺高血圧が生じるとも考えられている159).
最近の多施設研究から,POPHの進展には女性であることと自己免疫肝炎の2つが危険因子であり163),C型肝炎の合併はPOPH進展のリスクを低下させ9),その生命予後は肝硬変の存在および重症度と心機能に関連があると報告されている164).遺伝子レベルではエストロゲンシグナルが関与しておりestrogen recepter 1に変異があると増悪しやすいとされており,さらにカルシウム結合タンパクA4( S100A4)が過剰発現することで小動脈のリモデリングを助長し,内膜を増殖させ,肺高血圧を導くことが明らかになっている.また,ホスホジエステラーゼ5( PDE5) の遺伝子変異もPOPHを増悪させることが報告されており,PDE5-I であるシルデナフィルは内膜増殖の抑制・肺血管拡張を来たし,肺血行動態を改善すると考えられている165).
②予後,重症度評価
POPHは予後不良で,最近の報告によると,POPHで治療を行わなかった場合の5 年生存率は14%であり,54%の患者が診断から1年以内に死亡する166).肝移植を行わずPOPHの加療のみを行った場合の5年生存率は45%で,肝移植が行える場合,5年生存率は67%と改善する167).肝移植前に肺血管拡張薬を併用し,肺血行動態を改善した上で肝移植を行うことによってPOPHの予後が改善する可能性があるが,今後の検討が待たれる.
肝移植を行うためのPOPHの治療目標は mean PAPが35mmHg以下, かつPVRが250 dynes・sec・cm-5以下である3).これは肝移植前の mean PAPが35mmHg以上の患者は,35mmHg以下の患者に比べ有意に死亡率が高いため167), 肺血管拡張療法により mean PAP が35mmHg以下にならなければ肝移植は相対的に禁忌と考えられる.
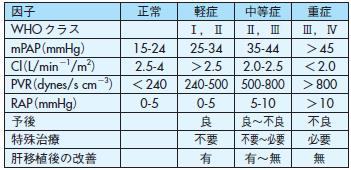
右心カテーテル検査はPOPHの重症度判定に非常に重要で168),疾患の重症度に応じて治療オプションを考慮する169)(表13).
③ POPH に特異的な診断基準と治療アルゴリズム
1)診断
POPHの診断基準を表14に示す3).肝硬変では全身血管抵抗の減少とそれに伴う心拍出量の増加を認めることがあり,その場合は心拍出量の増加に伴い肺動脈圧が上昇し,PVRが低下していることになる(肺肝症候群).肺肝症候群では一般的にPVRが低下することから,PVRの上昇がPOPHの特徴といえる.
診断のためには他の肺高血圧症と同様に,経胸壁心エコーでスクリーニングを行い,右心カテーテルで meanPAP,PAWP,CO(CI),PVRを測定し,POPHを診断
する.
2)治療(表15)
POPHに特異的な治療は肝移植である. 移植前にmean PAP 35mmHg以上の場合は予後不良であるため,PHの治療目標を, mean PAPが35mmHg未満,PVRが250 dynes/sec-cm-5 未満を目標とする3),170).
その他の治療は他のPAHと同様であるが,IPAHに使用する薬剤に関してPOPHで使用するにあたり注意が必要な場合がある.
まず利尿薬に関しては慎重に用いる必要がある.右心不全と慢性肝疾患に伴い血管内の血液量は増加しており,利尿薬はそれを減少させることで効果を認めるが,血液量が減少することで前負荷が減少し CO が減少する可能性がある171).抗凝固療法はIPAHや慢性肺塞栓症で有効であるが,肝硬変患者では易出血性であり,特に消化管出血の可能性が高くなるためPOPHには勧められない.
前述の通り,PDE5-I も有効で,PVRを低下させるが,シルデナフィルにより6分間歩行を1 年後に改善するものの, mean PAP,PVRに関して投与1年後には改善
を維持できなかった症例も報告されており172),今後検討が必要である.
プロスタサイクリン(エポプロステノール)はPOPHにも効果のある治療である.中等度から重症のPOPHではエポプロステノールの静脈注射が急性期も慢性期にも
肺血行動態および心負荷所見を改善する.
小規模試験ではあるが,ERAのボセンタンでPOPHの生存期間の延長と右心不全の再発減少を認め173),アンブリセンタンで血行動態を改善した試験が報告されている174).
これらの血管拡張薬の併用療法はIPAHではその有効性が示されているが,POPHでの併用に関しての報告は少なく167),これも今後の検討課題である.
門脈圧亢進症に伴うPAHは, 門脈肺高血圧症:portopulmonary hypertension( POPH) として知られている18),159).これは進行した肝疾患の既往の有無にかかわらず, 門脈圧亢進症に伴う肺高血圧症のことを指す17),160).POPHの病態生理はまだ十分に解明されていないが,進行したPOPHの肺動脈病変はIPAH のそれと類似している.有意なPOPHを有する肝疾患患者の予後は不良であるが,PAHに対する特異的治療薬がPOPH患者の予後を改善する報告もある.肺高血圧を有する肝移植患者も,その予後は不良であるため,肺動脈平均圧を35mmHg未満に低下させることが必要である.
①疫学,成因
最近のフランスの研究から,POPHはPAHの中で,IPAH,結合組織病に伴う肺高血圧症,先天性心疾患に伴うPAHに次いで,4 番目に多いと報告されており12),
門脈圧亢進症患者の2~6%にPOPHを有すると報告されている17),160)-162).POPHの成因はIPAHと異なり,まずシャントの出現や全身血管の拡張により高心拍出状態となるため,最初は肺血管抵抗が正常である.その後,肺血管へのshear stress が増加し,肺動脈内膜肥厚・肺動脈のリモデリングを生じ,肺動脈の閉塞・狭窄を来たし,肺血管抵抗が増加,さらにその部位に微小血栓が生じることでPOPHを生じると考えられている.進行するとPOPHの組織所見では血管内膜および中膜平滑筋の肥厚,血管内腔の叢状病変,壊死性血管炎やフィブリノイド壊死,微小血栓などを認める.また,肝疾患によるシャントの形成,肝代謝の低下により腸肝循環の代謝物質(セロトニンなど)が肺循環に流入することにより,肺の血管を収縮させ肺高血圧が生じるとも考えられている159).
最近の多施設研究から,POPHの進展には女性であることと自己免疫肝炎の2つが危険因子であり163),C型肝炎の合併はPOPH進展のリスクを低下させ9),その生命予後は肝硬変の存在および重症度と心機能に関連があると報告されている164).遺伝子レベルではエストロゲンシグナルが関与しておりestrogen recepter 1に変異があると増悪しやすいとされており,さらにカルシウム結合タンパクA4( S100A4)が過剰発現することで小動脈のリモデリングを助長し,内膜を増殖させ,肺高血圧を導くことが明らかになっている.また,ホスホジエステラーゼ5( PDE5) の遺伝子変異もPOPHを増悪させることが報告されており,PDE5-I であるシルデナフィルは内膜増殖の抑制・肺血管拡張を来たし,肺血行動態を改善すると考えられている165).
②予後,重症度評価
POPHは予後不良で,最近の報告によると,POPHで治療を行わなかった場合の5 年生存率は14%であり,54%の患者が診断から1年以内に死亡する166).肝移植を行わずPOPHの加療のみを行った場合の5年生存率は45%で,肝移植が行える場合,5年生存率は67%と改善する167).肝移植前に肺血管拡張薬を併用し,肺血行動態を改善した上で肝移植を行うことによってPOPHの予後が改善する可能性があるが,今後の検討が待たれる.
肝移植を行うためのPOPHの治療目標は mean PAPが35mmHg以下, かつPVRが250 dynes・sec・cm-5以下である3).これは肝移植前の mean PAPが35mmHg以上の患者は,35mmHg以下の患者に比べ有意に死亡率が高いため167), 肺血管拡張療法により mean PAP が35mmHg以下にならなければ肝移植は相対的に禁忌と考えられる.
右心カテーテル検査はPOPHの重症度判定に非常に重要で168),疾患の重症度に応じて治療オプションを考慮する169)(表13).
③ POPH に特異的な診断基準と治療アルゴリズム
1)診断
POPHの診断基準を表14に示す3).肝硬変では全身血管抵抗の減少とそれに伴う心拍出量の増加を認めることがあり,その場合は心拍出量の増加に伴い肺動脈圧が上昇し,PVRが低下していることになる(肺肝症候群).肺肝症候群では一般的にPVRが低下することから,PVRの上昇がPOPHの特徴といえる.
診断のためには他の肺高血圧症と同様に,経胸壁心エコーでスクリーニングを行い,右心カテーテルで meanPAP,PAWP,CO(CI),PVRを測定し,POPHを診断
する.
2)治療(表15)
POPHに特異的な治療は肝移植である. 移植前にmean PAP 35mmHg以上の場合は予後不良であるため,PHの治療目標を, mean PAPが35mmHg未満,PVRが250 dynes/sec-cm-5 未満を目標とする3),170).
その他の治療は他のPAHと同様であるが,IPAHに使用する薬剤に関してPOPHで使用するにあたり注意が必要な場合がある.
まず利尿薬に関しては慎重に用いる必要がある.右心不全と慢性肝疾患に伴い血管内の血液量は増加しており,利尿薬はそれを減少させることで効果を認めるが,血液量が減少することで前負荷が減少し CO が減少する可能性がある171).抗凝固療法はIPAHや慢性肺塞栓症で有効であるが,肝硬変患者では易出血性であり,特に消化管出血の可能性が高くなるためPOPHには勧められない.
前述の通り,PDE5-I も有効で,PVRを低下させるが,シルデナフィルにより6分間歩行を1 年後に改善するものの, mean PAP,PVRに関して投与1年後には改善
を維持できなかった症例も報告されており172),今後検討が必要である.
プロスタサイクリン(エポプロステノール)はPOPHにも効果のある治療である.中等度から重症のPOPHではエポプロステノールの静脈注射が急性期も慢性期にも
肺血行動態および心負荷所見を改善する.
小規模試験ではあるが,ERAのボセンタンでPOPHの生存期間の延長と右心不全の再発減少を認め173),アンブリセンタンで血行動態を改善した試験が報告されている174).
これらの血管拡張薬の併用療法はIPAHではその有効性が示されているが,POPHでの併用に関しての報告は少なく167),これも今後の検討課題である.
表13 Portopulmonary hypertensionの重症度判定
mPAP=mean pulmonary artcrial pressure;Cl=cardiac index;PVR=
pulmonary vascular resistance;RAP=right atrial pressure;OLT=
orthotropic liver transplantation, POPH=portopulmonary
hypertension
文献169より改変
pulmonary vascular resistance;RAP=right atrial pressure;OLT=
orthotropic liver transplantation, POPH=portopulmonary
hypertension
文献169より改変
表14:Portopulmonary hypertensionの診断基準
the European Respiratory Society Pulmonary Hepatic Vascular
Disorder Task Force 2004 Consensus Report3)
Disorder Task Force 2004 Consensus Report3)
表15 門脈圧亢進症に伴うPAHに対する治療
Ⅱ 各論 >
1 肺動脈性肺高血圧症(PAH) >
3 門脈圧亢進症に伴う肺動脈性肺高血圧症