肺高血圧症治療ガイドライン(2012年改訂版)
Guidelines for Treatment of Pulmonary Hypertension(JCS2012)
Guidelines for Treatment of Pulmonary Hypertension(JCS2012)
肺動脈性肺高血圧症の診断には,右心カテーテル検査による
肺動脈性の肺高血圧の診断とともに,臨床分類における鑑別診
断,および他の肺高血圧を来たす疾患の除外診断が必要である.
(1) 主要症状および臨床所見
① 労作時の息切れ
② 易疲労感
③ 失神
④ 肺高血圧症の存在を示唆する聴診所見(Ⅱ音の肺動脈
成分の亢進など)
(2) 検査所見① 右心カーテル検査で⒜ 肺動脈圧の上昇(安静時肺動脈平均圧で25mmHg以上,肺血管抵抗で240dyne・sec・cm-5以上)
⒝ 肺動脈楔入圧(左心房圧)は正常(15mmHg 以下)② 肺血流シンチグラムにて区域性血流欠損なし(突発性または遺伝性肺動脈性肺高血圧症では正常または斑状の血流欠損像を呈する(3) 参考とすべき検査所見① 心エコー検査にて,三尖弁収縮期圧較差40mmHg以上で,推定肺動脈圧の著明な上昇を認め,右室肥大所見
を認めること.② 胸部X線像で肺動脈本幹部の拡大,末梢肺血管陰影の細小化③ 心電図で右室肥大所見
(4) 肺動脈性肺高血圧症の臨床分類以下のいずれかについて識別すること.① 突発性または遺伝性肺動脈性肺高血圧症② 膠原病に伴う肺動脈性肺高血圧症
③ 先天性シャント性心疾患に伴う肺動脈性肺高血圧症④ 門脈圧亢進症に伴う肺動脈性肺高血圧症⑤ HIV感染に伴う肺動脈性肺高血圧症⑥ 薬剤/毒物に伴う肺動脈性肺高血圧症⑦ 肺静脈閉塞性疾患,肺毛細血管腫症⑧ 新生児遷延性肺高血圧症ただし,先天性シャント性心疾患に伴う肺動脈性肺高血
圧症の場合は,手術不能症例,および手術施行後も肺動脈性肺高血圧症が残存する場合を対象とする.その際は,心臓カテーテル検査所見,心エコー検査所見,胸部X線・胸部CTなどの画像所見,などの検査所見を添付すること.(5) 下記の肺高血圧を来たす疾患を除外できること 以下の疾患は肺動脈性肺高血圧症とは病態が異なるが,肺高血圧ひいては右室肥大,慢性肺性心を招来し得るので,これを除外する.① 左心系疾患による肺高血圧症② 呼吸器疾患および/または低酸素血症による肺高血圧症
③ 慢性血栓塞栓性肺高血圧症④ その他の肺高血圧症 サルコイドーシス,ランゲルハンス細胞組織球症,リンパ脈管筋腫症,大動脈炎症候群,肺血管の先天性異常,肺動
脈原発肉腫,肺血管の外圧迫などによる二次的肺高血圧症
ただし,呼吸器疾患および/または低酸素血症による肺高
血圧症では,呼吸器疾患および/または低酸素血症のみでは
説明のできない高度の肺高血圧症が存在する症例がある.こ
の場合には肺動脈性肺高血圧症の合併と診断してよい.その
際には,心臓カテーテル検査所見,胸部X線,胸部CTなどの
画像所見,呼吸機能検査所見などの検査所見を添付すること.
(6) 認定基準
以下の項目をすべて満たすこと.
① 新規申請時
1)診断のための検査所見を右心カーテル検査所見および
肺血流シンチグラム所見を満たすこと.
2)除外すべき疾患のすべてを除外できること.
3)肺動脈性肺高血圧症の臨床分類①~⑧のどれに該当す
るのかを鑑別すること.
② 更新時
1)参考とすべき検査所見の中の心臓エコー検査の所見を
満たすこと.
2)参考とすべき検査所見の中の胸部X線所見か心電図所
見のいずかを有すること.
3)除外すべき疾患のすべてを除外できること.
4)肺動脈性肺高血圧症の臨床分類①~⑧のどれに該当す
るのかを鑑別すること.
なお,更新時には,肺高血圧の程度は新規申請時よりは軽
減もしくは正常値になっていても,肺血管拡張療法などの
治療が必要な場合は認める.
肺動脈性の肺高血圧の診断とともに,臨床分類における鑑別診
断,および他の肺高血圧を来たす疾患の除外診断が必要である.
(1) 主要症状および臨床所見
① 労作時の息切れ
② 易疲労感
③ 失神
④ 肺高血圧症の存在を示唆する聴診所見(Ⅱ音の肺動脈
成分の亢進など)
(2) 検査所見① 右心カーテル検査で⒜ 肺動脈圧の上昇(安静時肺動脈平均圧で25mmHg以上,肺血管抵抗で240dyne・sec・cm-5以上)
⒝ 肺動脈楔入圧(左心房圧)は正常(15mmHg 以下)② 肺血流シンチグラムにて区域性血流欠損なし(突発性または遺伝性肺動脈性肺高血圧症では正常または斑状の血流欠損像を呈する(3) 参考とすべき検査所見① 心エコー検査にて,三尖弁収縮期圧較差40mmHg以上で,推定肺動脈圧の著明な上昇を認め,右室肥大所見
を認めること.② 胸部X線像で肺動脈本幹部の拡大,末梢肺血管陰影の細小化③ 心電図で右室肥大所見
(4) 肺動脈性肺高血圧症の臨床分類以下のいずれかについて識別すること.① 突発性または遺伝性肺動脈性肺高血圧症② 膠原病に伴う肺動脈性肺高血圧症
③ 先天性シャント性心疾患に伴う肺動脈性肺高血圧症④ 門脈圧亢進症に伴う肺動脈性肺高血圧症⑤ HIV感染に伴う肺動脈性肺高血圧症⑥ 薬剤/毒物に伴う肺動脈性肺高血圧症⑦ 肺静脈閉塞性疾患,肺毛細血管腫症⑧ 新生児遷延性肺高血圧症ただし,先天性シャント性心疾患に伴う肺動脈性肺高血
圧症の場合は,手術不能症例,および手術施行後も肺動脈性肺高血圧症が残存する場合を対象とする.その際は,心臓カテーテル検査所見,心エコー検査所見,胸部X線・胸部CTなどの画像所見,などの検査所見を添付すること.(5) 下記の肺高血圧を来たす疾患を除外できること 以下の疾患は肺動脈性肺高血圧症とは病態が異なるが,肺高血圧ひいては右室肥大,慢性肺性心を招来し得るので,これを除外する.① 左心系疾患による肺高血圧症② 呼吸器疾患および/または低酸素血症による肺高血圧症
③ 慢性血栓塞栓性肺高血圧症④ その他の肺高血圧症 サルコイドーシス,ランゲルハンス細胞組織球症,リンパ脈管筋腫症,大動脈炎症候群,肺血管の先天性異常,肺動
脈原発肉腫,肺血管の外圧迫などによる二次的肺高血圧症
ただし,呼吸器疾患および/または低酸素血症による肺高
血圧症では,呼吸器疾患および/または低酸素血症のみでは
説明のできない高度の肺高血圧症が存在する症例がある.こ
の場合には肺動脈性肺高血圧症の合併と診断してよい.その
際には,心臓カテーテル検査所見,胸部X線,胸部CTなどの
画像所見,呼吸機能検査所見などの検査所見を添付すること.
(6) 認定基準
以下の項目をすべて満たすこと.
① 新規申請時
1)診断のための検査所見を右心カーテル検査所見および
肺血流シンチグラム所見を満たすこと.
2)除外すべき疾患のすべてを除外できること.
3)肺動脈性肺高血圧症の臨床分類①~⑧のどれに該当す
るのかを鑑別すること.
② 更新時
1)参考とすべき検査所見の中の心臓エコー検査の所見を
満たすこと.
2)参考とすべき検査所見の中の胸部X線所見か心電図所
見のいずかを有すること.
3)除外すべき疾患のすべてを除外できること.
4)肺動脈性肺高血圧症の臨床分類①~⑧のどれに該当す
るのかを鑑別すること.
なお,更新時には,肺高血圧の程度は新規申請時よりは軽
減もしくは正常値になっていても,肺血管拡張療法などの
治療が必要な場合は認める.
予後良好予後決定因子予後不良
無右心不全の既往有
遅症状の進行度速
無失神有
Ⅰ,Ⅱ WHO- 機能分類Ⅲ,Ⅳ
500m以上6MWT 300m以下
15mL/min/Kg以上CPX
(最大酸素摂取量) 12mL/min/Kg以下
正常,ほぼ正常BNP
非常に高値,
上昇傾向
心嚢液(-),
TAPSE>2.0cm
心エコー所見心嚢液(+),
TAPSE<1.5cm
RA圧<8mmHg
Cl >2.5L/min/m2 肺血行動態RA圧≧8mmHg
Cl <2.0L/min/m2
無右心不全の既往有
遅症状の進行度速
無失神有
Ⅰ,Ⅱ WHO- 機能分類Ⅲ,Ⅳ
500m以上6MWT 300m以下
15mL/min/Kg以上CPX
(最大酸素摂取量) 12mL/min/Kg以下
正常,ほぼ正常BNP
非常に高値,
上昇傾向
心嚢液(-),
TAPSE>2.0cm
心エコー所見心嚢液(+),
TAPSE<1.5cm
RA圧<8mmHg
Cl >2.5L/min/m2 肺血行動態RA圧≧8mmHg
Cl <2.0L/min/m2
Class Ⅰ
1. 右心不全,体液貯留患者に対する利尿薬 (Level C)
2. SaO2<60mmHgのPAHに対する
長期酸素療法 (Level C)
Class Ⅱa
1. IPAH,HPAH,食欲抑制剤に伴う
PAHに対する抗凝固療法 (Level C)
Class Ⅱb
1. 他疾患に併発するPAHに対する抗凝固療法 (Level C)
2. 心房性の頻脈に対するジゴキシン (Level C)
1. 右心不全,体液貯留患者に対する利尿薬 (Level C)
2. SaO2<60mmHgのPAHに対する
長期酸素療法 (Level C)
Class Ⅱa
1. IPAH,HPAH,食欲抑制剤に伴う
PAHに対する抗凝固療法 (Level C)
Class Ⅱb
1. 他疾患に併発するPAHに対する抗凝固療法 (Level C)
2. 心房性の頻脈に対するジゴキシン (Level C)
ClassⅠ
1.監視下運動療法 (Level A)
2.心理的・社会的支援 (Level C)
3.過激な身体的活動の回避 (Level C)
4.避妊 (Level C)
5.インフルエンザ・肺炎球菌の予防接種 (Level C)
1.監視下運動療法 (Level A)
2.心理的・社会的支援 (Level C)
3.過激な身体的活動の回避 (Level C)
4.避妊 (Level C)
5.インフルエンザ・肺炎球菌の予防接種 (Level C)
225 例中142 例で
併用療法
(28 施設)
静注PGI2+ボセンタン(2.8%) 3剤併用(4.2%)
静注PGI2
+シルデナフィル(2.8%)
シルデナフィル
+ボセンタン
(16.2%)
ベラプロスト徐放薬+シルデナフィル(3.5%)
ベラプロスト徐放薬
+ボセンタン(9.9%)
ベラプロスト
+ボセンタン
(43.0%)
ベラプロスト
+シルデナフィル
併用療法
(28 施設)
静注PGI2+ボセンタン(2.8%) 3剤併用(4.2%)
静注PGI2
+シルデナフィル(2.8%)
シルデナフィル
+ボセンタン
(16.2%)
ベラプロスト徐放薬+シルデナフィル(3.5%)
ベラプロスト徐放薬
+ボセンタン(9.9%)
ベラプロスト
+ボセンタン
(43.0%)
ベラプロスト
+シルデナフィル



肺動脈性肺高血圧症の診断
一般的処置 支持療法
多剤逐次追加併用療法 ( I-A) 治療効果不十分
治療効果不十分
肺移植(I-C)
CCB(I-C)
反応なし
安定/ 改善なし
NYHA/WHO Ⅰ,Ⅱ
で安定/ 満足
専門施設への紹介
急性肺血管反応性試験(I-C)
治療続行
反応あり
認可PAH 治療薬による初期治療
推薦度エビデンスNYHA/WHOⅡ NYHA/WHOⅢ NYHA/WHO Ⅳ
Ⅰ A or B
ERA
PDE5-I
ERA,
PDE5-I
Epoprostenol iv
Epoprostenol iv
Ⅱa C ERA
PDE5-I
B Beraprost
Ⅱb
C 初期併用療法初期併用療法図5補足
ERA: エンドセリン受容体拮抗薬(アンブリセンタン,ボセンタン)
PDE5Ⅰ: ホスホジエステラーゼ5阻害薬(シルデナフィル,タダラフィル)
一般的処置 支持療法
多剤逐次追加併用療法 ( I-A) 治療効果不十分
治療効果不十分
肺移植(I-C)
CCB(I-C)
反応なし
安定/ 改善なし
NYHA/WHO Ⅰ,Ⅱ
で安定/ 満足
専門施設への紹介
急性肺血管反応性試験(I-C)
治療続行
反応あり
認可PAH 治療薬による初期治療
推薦度エビデンスNYHA/WHOⅡ NYHA/WHOⅢ NYHA/WHO Ⅳ
Ⅰ A or B
ERA
PDE5-I
ERA,
PDE5-I
Epoprostenol iv
Epoprostenol iv
Ⅱa C ERA
PDE5-I
B Beraprost
Ⅱb
C 初期併用療法初期併用療法図5補足
ERA: エンドセリン受容体拮抗薬(アンブリセンタン,ボセンタン)
PDE5Ⅰ: ホスホジエステラーゼ5阻害薬(シルデナフィル,タダラフィル)
要旨
旧来の典型的なIPAH/HPAHの臨床像としては,まず極めて稀な,特に原因と思われる基礎疾患を持たない高度の肺高血圧を主徴とする疾患であることがあげられる.男女比は1:1.7と女性に多く,発症年齢も若年で,妊娠可能年齢の若い女性に好発することも特徴である75).発症頻度は100万人に1~2人と稀な疾患で,治療介入を行わなかった場合,診断からの平均生存期間が2.8年と非常に予後不良で76)あった.しかし最近の検討では小児期にも好発年齢帯が存在し,この時期の発症例では性差はないことも知られてきた.
本症は以前は治療法が皆無であったが,1990年以降に次々と治療薬が開発され,現時点では作用機序の異なる3種類の治療薬が存在し,これらの単剤または組み合わせ治療により生命予後は改善してきた.しかし薬剤抵抗性の例では,適切な時期に肺移植を考慮する必要がある.HPAHはPAHの中では唯一,遺伝子異常が確認され10),11),63),77),78), 遺伝性疾患として認識されたが,IPAHについては発症原因は現在も不明である.
①疫学,成因
1)疫学
我が国では1998年から旧来のPPH( 現在のIPAH/HPAH)が特定疾患治療研究事業対象疾患(いわゆる難病)に指定され,臨床調査個人票による疫学調査が始まった.本調査が我が国では唯一の公的・全国的な疫学情報である.しかしこの登録例にはIPAH/HPAHに加えて他のPAH例が含まれている可能性が高く,厳密な意味では我が国のIPAH/HPAHの症例数とはいえないことが指摘されている.2009年10月より特定疾患治療研究事業対象疾患の「PPH」は世界標準の疾患概念である「PAH」に改訂され,IPAH/HPAHに加え,結合組織病に伴うPAHや先天性心疾患PAHも難病のPAHとして登録可能になった.2011年の統計ではPAH登録証例数は1,969例であり,今後この内容を解析することにより我が国のIPAH/HPAH症例数が明らかになることが期待される.
海外における疫学情報では,米国で行われた最初のPPHに関する症例登録で100万人に1~2人と報告された79).フランスの国家登録作業では2002年に18歳以上のPAHが674例登録され,その中でIPAH/HPAHは290例であった.これより,本症の有病率は4.8人/100万人と計算された12).2006年の米国REVEAL登録研究では2,525例のPAHが登録され,内IPAHは1,166例であった80).
2)成因
HPAHの発症原因として遺伝子異常の存在が確認されている.これまでの報告ではHPAHの 約70 % に,家族歴の確認されていないIPAHと診断された例でも約20 %にBMPR2遺伝子の変異の存在が確認されている10),77).また,本来は遺伝性出血性毛細血管拡張症の原因遺伝子であるACVRL1遺伝子や 小児例では,endoglinの遺伝子異常が発見され81),82),最近では SMAD962),78)や caveolin-1(CAV1)の遺伝子変異63)も報告されている.しかし,遺伝子変異のない例における発症原因は未解決である.PAHの成因に関しては前項(6 肺高血圧症の病因)を参照していただきたい.
②診断方法
IPAH/HPAHの診断手順は総論に記載された方法に準じる.概略すると,診断は肺高血圧の存在診断,肺高血圧症の鑑別診断,および重症度評価の要素から構成されている.IPAH/HPAHは多くの場合,原因不明の労作時呼吸困難か失神発作が初発症状となる.
心電図,胸部X線写真から肺高血圧の存在が疑われた場合,心エコー・ドプラ法により肺高血圧の確定と半定量評価を行う.同時に他の心肺疾患の存在を検索する.合併疾患が存在せず固定した肺高血圧が存在すれば,第1群のPAHか第4群のCTEPHの可能性が高いと判断される.この両者の鑑別には肺換気─血流シンチグラムが極めて有効であるが,造影CTで鑑別が可能な場合もある.これら検査結果の解釈は容易でない場合も多く,正確な診断は経験のある専門施設で行われることが望ましい.
PAHである可能性が高いと診断された場合には,CTD-PAHやPOPH,CHD-PAH,PVOD/PCHを血液検査や画像検査で除外しつつ,右心カテーテルで肺血行動態を測定して確定診断,重症度評価を行う.運動耐容能などの評価も治療方針決定に有用である.IPAHとHPAHの鑑別は,一般診療の場では詳細な病歴聴取を行う以外に方法はない.遺伝子診断に関しては,検査が可能な施設は我が国では数か所存在し,確定診断も可能である.ただし,遺伝子検査は必須でもなく,また強制するべき検査でもない.表7には2010年に改訂された厚労省難治性疾患克服研究事業で定められたPAHの診断基準を示す.
③予後・重症度評価
1)予後
IPAH/HPAH の自然歴は極めて不良で,旧来の報告では,発症後の平均生存期間は成人例未治療の場合 2.8年で,死因は突然死,右心不全,喀血が多いとされていた76).小児の未治療IPAH/HPAH の予後は成人に比較してさらに不良で,平均生存期間が10か月であると報告されている76).
我が国ではIPAH/HPAHの自然予後に関する全国規模でのデータは存在しない.単施設の結果ではあるが,治療薬が存在しなかった時期の自験例(国立循環器病研究センター)198例の調査の結果では,1年生存率,3 年生存率,5年生存率が各々67.9%,40.2%,38.1%であり,海外例との間に予後に大きな差異は認めらなかった83).近年の欧米における大規模症例登録の解析結果では,本症の予後は改善してきており,フランスの報告ではIPAH/HPAH/薬剤性PAHの1 年生存率,3年生存率,5年生存率が各々89%,77%,69% 84),米国REVEAL登録研究ではIPAH/HPAHの1年生存率 ,3年生存率,5年生存率,7年生存率はそれぞれ 91%, 74%, 65%,59%であった85).これは最近の特異的PAH治療薬の開発に負うところが大と考えられる.
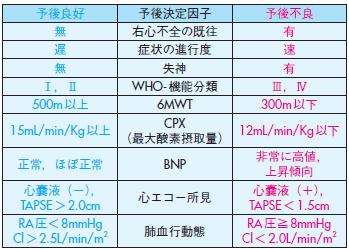
2)重症度/予後評価
以前のIPAH/HPAH の重症度/予後評価では,肺血行動態上の諸指標が重視され,これより予後を算出する計算式も提案されていた76).しかし現在では病状の進行度や失神, 右心不全の既往などの臨床症状の有無,NYHA/WHO肺高血圧症機能分類度,運動負荷試験(6分間歩行試験・心肺運動負荷試験)40),44),心エコー法で心嚢液の有無,TAPSE 31)などの生理学的指標や,BNP 23),血中尿酸値27)などのバイオマーカー値などを総合して重症度評価や治療効果判定を行うことが主流となってきている.ESC/ERSのガイドラインでは表8が重症度/予後と治療方針を決定するための参考にされ,病状を予後がよい指標とされる項目を多く含む順に「安定し,満足している」,「安定しているが,十分でない」,「不安定で,悪化してる」と分類し,治療方針決定に用いている3).また最近の米国のREVEAL症例登録研究からは,新たにPAHの予後についてのリスク スコアー計算法も発表されている86).これらの評価では,肺循環動態諸指標に関しては,肺動脈圧自身よりむしろ右房圧や心拍出量係数,肺血管抵抗が重視され,混合静脈血酸素飽和度(Svo2)も重症度評価には有用である.
④ IPAH/HPAH の内科治療
IPAH/HPAHに対する内科的治療法は近年飛躍的に発展した.現在我が国ではプロスタサイクリン経路に属するプロスタサイクリンとその誘導体,エンドセリン経路に属するエンドセリン受容体拮抗薬(endothelin receptor antagonist: ERA),および一酸化窒素(NO)経路に属するホスホジエステラーゼ5阻害薬(phosphodiesterase type-5 inhibitor: PDE5-I)のそれぞれ異なった3系統の特異的PAH治療薬が存在する.
欧米ではこれらの薬剤が認可される際,および市販後にも特異的PAH治療薬の治療効果について多くの臨床試験が行われ,種々のエビデンスが集積されてきた.そこで2008年のダナポイント会議では,当時の治療エビデンスを集約したPAH治療ガイドラインの作成が試みられ,2009年にはこれを成文化したPAH治療ガイドラインが Journal of the American College of Cardiology 誌(JACC)1)に発表された.またこの内容をより具体化したESC/ERS肺高血圧症治療ガイドライン3)がEuropean Heart Journal誌に掲載され,ほぼ同内容のERSガイドライン4)もEuropean Respiratory Journal 誌に掲載されている.しかし我が国では肺高血圧症治療薬の大規模な臨床試験はなく,日本人に関するエビデンスにより独自のPAH治療ガイドラインを作成することは困難である.このため本日本循環器学会ガイドラインはJACCおよびESCやERSのPAHガイドライン,および2013年2月のニース会議の発表内容を基本とし,我が国では発売されていない治療薬は除いて作成した.
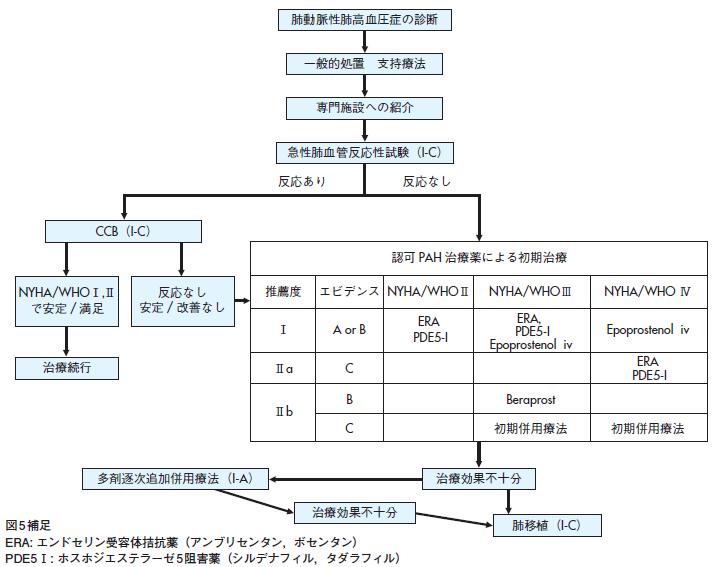
1)IPAH/HPAH の治療指針概略(図5)
IPAH/HPAHの治療指針は,まずIPAH/HPAHの確定診断と重症度評価を行いつつ,以下の一般的対応/支持療法を開始する(表9,表10).PAHでは基本的にはワルファリンを用いて抗凝固療法を行う.低酸素血症があれば酸素投与の適応と考えられ,我が国では肺高血圧症の診断で在宅酸素療法の健康保険の適応が得られている.右心不全症状があれば利尿薬の投与や,心房性頻拍症があればジゴキシンを用いる場合もある.妊娠は禁忌とされ,感染症予防の目的でインフルエンザや肺炎球菌の予防接種が勧められている.
これらの支持療法を行いつつ,IPAH/HPAHについてはまずNO吸入かエポプロステノール静注法を用いた急性肺血管反応性試験を行うことが推奨される.急性肺血管反応性試験の詳細は「肺高血圧症の診断」の項を参照されたい.肺血管反応性が陽性の症例についてはカルシウムチャンネル拮抗薬(CCB) 療法が推奨される.CCB治療開始後にNYHA/WHO機能分類のⅡ度またはⅠ度に改善すれば本治療を続行する.
急性肺血管反応性試験の陰性例,またはCCB治療を行っても症状の改善がみられない例については特異的PAH治療薬を速やかに開始する.特異的PAH治療薬には前述のように3系統の治療薬が存在し,そのいずれかを用いて治療を開始するが,NYHA/WHO機能分類の観点からⅡ度・Ⅲ度例に対しては,ERA,PDE5-I の薬剤は適応とするエビデンスがある.またNYHA/WHO機能分類Ⅲ度例の中でも特に「症状の進行速度など」他の重症度指標で予後不良の項目が多い重症例ではエポプロステノールの適応を考慮する.NYHA/WHO機能分類Ⅳ度例はエポプロステノールの適応である.
単剤で十分な治療効果が得られない場合,現在は2剤,3剤の併用療法が行われている.特異的PAH治療薬の各々については有効性を示すエビデンスの蓄積はある.しかしこれら薬剤の併用療法については組み合わせ方や順番,注意点についての情報は少なく,詳細は分かっていない.しかし「異なる作用機序をもつ治療薬の併用療法」という治療方針は,多くの専門家の合意は得られており,また有効であるとのエビデンスも蓄積しつつある.
PAHに対する併用療法には,特定の治療到達目標を定め,その目標に到達するように逐次PAH治療薬を追加してゆく目標指向型治療(goal-oriented therapy)(treat-totarget therapy)である sequential combination therapyと,特に具体的な治療目標を設定せず治療初期から複数の治療薬をほぼ時間差なく併用開始するupfront combination therapy/ upfront triple combination therapyがある.さらに目標指向型治療では治療目標を一定の運動耐容能に設定する方法や88),運動耐容能に加えて予後不良とされるax複数の重症度指標を設定し,これを減じるように投薬を追加する方法がある.目標指向型治療法を実践した最初の研究では,ボセンタンを初期治療薬として用い,シルデナフィル,iloprost(吸入,静注)を必要に応じて逐次追加することで3年生存率は79.9%と有意に延長したと報告されている88).
2009年のESC/ERSの肺高血圧治療ガイドラインでは,治療対象例の重症度を表8に示す各項目について評価し,まず任意の特異的PAH治療薬を単剤で開始する.治療は重症度指標の各項目について3~ 6か月ごとに評価を行い,病状が治療目標を満足していない場合,逐次治療薬を追加する3),4).しかし,具体的な治療薬の選択法についての言及は行われていない.右心カテーテルは治療開始,治療変更の3~ 4か月後,および臨床的増悪が認められた場合に施行することを推奨している.
Upfront combination therapy に関しては,我が国でも多くの専門家が有用であると考え,すでに実際に行われている場合も多い.しかし,いわゆるエビデンスとしては,論文報告は少なく,既存の報告としてはNYHA/WHO機能分類のⅢ~Ⅳ度の重症例を対象にボセンタンとエポプロステノールを併用した upfront therapyの結果がある程度である89),90).現在,欧州ではYHA/WHO機能分類のⅡ~Ⅲ度例についての有効性や,治療薬の組み合わせ(2剤,3剤併用を含む)につき治験が進行中である.upfront combination therapyの具体的な手順も,今後の検討課題である.
近年「IPAH/HPAHの治療目標をいかに設定するか?」に関して様々な議論が行われている.ESC/ERSのガイドラインなど欧米では予後決定因子を総合的に評価し「安定し,満足している」を治療目標とし,これを達成することが予後の改善につながると考え91),肺血行動態の正常化に関しては,これを絶対目標とはしていない場合が多い.一方,我が国では治療目標はあくまで肺血行動態の正常化を目指すべきであり,このために治療薬の増量・併用を積極的に勧めるとの考え方がある.ただしIPAH/HPAHでは,積極的治療により肺血行動態の正常化が達成される例もあるがEisenmenger 症候群などのCHD-PAHでは肺血行動態の正常化は極めて困難な場合が多い.同じ第1群に属していても各PAHで治療に対する反応性は大きく異なっている可能性がある.各PAH疾患の特性を把握し,治療目標を設定する作業は,現時点では各々の担当医の判断に委ねられており,そのためにも治療方針決定は十分な経験を持った施設で行われることが必要である.
内科的治療法に反応しない例は心房中隔裂開術や肺移植の適応とされている.しかし我が国では心房中隔裂開術の報告はほとんどなくガイドラインには採用しなかった.一方,IPAH/HPAHに対する肺移植は近年ようやく現実の治療法となってきたが,未だ実施例は多くはない.
以上IPAH/HPAHの治療指針について概略した.本指針を臨床の場で参考にする場合の注意点としては,まず本項の記載内容は第1群PAHのみを対象としたものであり,第2 群~4群肺高血圧症の治療指針とはならないことに留意する.さらに,ここに記載した多くの臨床試験は,第1 群PAHでも主としてIPAH/HPAHが対象患者となり,CTD-PAHやCHD-PAHなど例の参加は多くはない. 近年同じPAHに属していても,IPAH/HPAH,CTD-PAH,CHD-PAHなど各々は病因・病態や臨床像,生命予後は大きく異なっていることが報告されてきている92).したがってIPAH/HPAHに対する治療指針がすべてのPAHに同一に適応される訳ではなく,各PAHに対する治療は各々の病態に応じて工夫する必要がある.
2)抗凝固療法
IPAH/HPAHおよび食欲減退薬によるPAHを対象とした3つの後ろ向き研究で,ワルファリンにより生命予後が改善されることが示されている93)-95).ワルファリンの用量は,PT-INRを1.5~ 2.5を目標とする場合が多い.しかし,これらの成績はすべてエポプロステノールが使用できない時代のものである.エポプロステノール持続静注法では,カテーテル由来の血栓を起こす可能性があるが,一方で強力な抗血小板凝集抑制作用による出血性の合併症も考えなければならない.Ogawa らはエポプロステノールと抗凝固療法の併用により肺胞出血の危険性が高くなる可能性を指摘している96).他の疾患に伴うPAHでは,出血性合併症(門脈─肺高血圧症の消化管出血や先天性心疾患における奇異性塞栓や肺胞出血の頻度など)の多寡により投与の有無や用量を決める.
3)利尿薬
右心不全により水分貯留が起こり,そのコントロールのために用いられる.ループ利尿薬,サイアザイド系利尿薬,抗アルドステロン薬を単独あるいは併用する.使用に際しては,電解質異常や過度の血管内脱水による低血圧の発生,低心拍出の進行に十分注意を払う.
4)長期酸素療法(在宅酸素療法)
酸素吸入はPAH例において平均肺動脈圧と肺血管抵抗を低下させる急性効果を有している97),98).一般に,慢性閉塞性肺疾患で証明されたと同様の生命予後改善を期待して,動脈血酸素分圧を60mmHg以上に保つ酸素投与が行われている.しかし,CHD-PAHを対象とした唯一の無作為割付試験では,2年間の酸素療法では死亡率の改善は示されなかったとの報告もある99).
5)ジギタリス製剤
ジギタリス製剤は動物実験では弱い肺血管収縮作用が示されている100).肺高血圧患者に対する急性効果では心拍出量は増加し,肺血管抵抗は不変であった101).しかし,慢性効果については明らかでなく,心拍コントロールの際に考慮すべき薬剤として位置づけられている.
6)その他の強心薬
重症右心不全の治療,あるいは肺血管拡張薬の導入時にカテコラミンを利用する場合がある.体血圧が比較的保たれている場合にはドブタミンが選択されるが,保たれない場合にはドパミン単独あるいはドブタミンと併用する.カテコラミンからの離脱にはピモベンダン,ドカルパミン,デノパミンなどの経口心不全治療薬が必要なこともある.
7) カルシウムチャンネル拮抗薬(calcium channel blocker: CCB)
現在の特異的PAH治療薬が臨床応用開始される以前の1992年に,Richらは,急性肺血管反応性試験で反応例については高用量のCCBを投与して予後が改善することを初めて示した93).ただしCCBが著効する症例の割合は低く,また長期的に有効性が維持されるのは急性肺血管反応性試験の陽性例の半数に過ぎず37),反応例は若年者で多いことが知られている102).CCBが有効な例はIPAH/HPAHに限定される可能性も指摘されており,本治療薬の適応は極めて限られる.また急性肺血管反応性試験もそれ自体常に一定の危険性が存在し,肺高血圧症の治療に精通した専門施設でのみ実施されることが強く推奨されている.
使用される薬剤としてはニフェジピン,ジルチアゼム,アムロジピンが一般的である.欧米ではニフェジピンの120~ 240mg,ジルチアゼムの240~ 720mgの高用量が用いられているが,我が国ではこの使用量は困難で,最小量より開始し適正量を見つけることが肝要である.
8)特異的PAH 治療薬
PAHの病態は,発症初期には高度の肺動脈攣縮が生じ,その後これに器質化病変が加わり,肺高血圧症が固定化すると考えられている.近年,肺血管に選択性の高い3系統の血管拡張薬,すなわちプロスタサイクリン経路,エンドセリン経路,一酸化窒素(NO)経路の薬剤が開発され,本症に対する内科治療が本格的に開始されている.
① エンドセリン受容体拮抗薬(endothelin receptor antagonist: ERA)
ERAにはエンドセリンAおよびB受容体の両者に対する拮抗薬であるボセンタンと,エンドセリンA受容体に選択性が高いアンブリセンタンがある.平滑筋細胞に存在するエンドセリンA受容体への刺激は血管平滑筋収縮と増殖,炎症・線維化を誘導・促進する.一方,エンドセリンB受容体は正常では主に血管内皮細胞に存在し,刺激により一酸化窒素やプロスタサイクリン産生を亢進することで血管を拡張させる.しかし肺高血圧症例においてエンドセリンB受容体は血管内皮細胞では減少,平滑筋細胞では増加する.それゆえ,肺高血圧治療にエンドセリンA受容体に選択性の高い薬剤と選択性のない薬剤に優劣があるのかについては議論がある.
○ボセンタン
エンドセリン受容体拮抗薬としては最初の経口薬剤で,2005年に日本でも処方可能となった.主なランダム化比較試験には対象の90%がNYHA/WHO機能分類
ⅢのIPAHまたはSSCに伴うPAHであったBREATHE-1 103),先天性心疾患に由来するPAHを対象としたBREATHE-5 104),NYHA/WHO機能分類Ⅱを対象とし
たEARLY試験105)がある.BREATHE-1,BREATHE-5,EARLY試験では,それぞれ16週間,16週間,6か月でのボセンタンによる6 分間歩行距離の改善が確認
された.また,ボセンタンを第一選択薬とした際の長期生命予後はNIH登録の予測式から計算された予後より改善することが示された106),107).有害事象としては血清トランスアミナーゼ上昇が10%未満に出現する.この肝機能異常は用量依存性であり,中断や減量で改善する.定期的な肝機能検査が必要である.ESC/ERSガイドラインではNYHA/WHO機能分類Ⅱ,Ⅲ度がボセンタンのよい適応で,Ⅳ度例への投与のエビデンスレベルはやや低下する.我が国でも同様の対応としてよい.
ボセンタンの投与法は,投与開始後4週間は62.5mgを1日2回,5週目より125mgを必要に応じて1 日2回投与する.
○アンブリセンタン
アンブリセンタンの最初の臨床試験結果は2005年に発表され108),その後のNYHA/WHOⅠ~Ⅳ度のIPAH/HPAH,CTD-PAHを対象とした2 つのランダム化比較試験(ARIES-1,ARIES-2)で治療期間12週間後に6分間歩行距離の改善が確認され109),それに続く2 年の長期投与でも運動能が保たれていた110).試験は1日投与量が2.5mg,5mg,10mgの3 群で実施されたが,全症例をプールした解析では1年生存率が94%,2 年生存率が88%であった.また,血清トランスアミナーゼが正常上限の3 倍を超える上昇は年間2%以下とされるが109),末梢浮腫の発現が報告されている.我が国での採用は2010年である.
アンブリセンタンの投与法は,5mgを1日1回,その後必要に応じて10mgを1日1回投与する.
② ホスホジエステラーゼ5 阻害薬(phosphodiesterase type-5 inhibitor: PDE5-I)
PDE5 は肺組織,特に肺血管平滑筋細胞に豊富に存在し,血管拡張作用を有するcGMPを特異的に加水分解する.PDE5-I はこのPDE5 を阻害することで,肺動脈血管平滑筋を弛緩させる.現在,我が国でPAH治療に承認されているPDE5-I としてはシルデナフィルとタダラフィルが存在し,両剤ともに経口薬である.肺血管選択性があるが,過度の体血圧低下を来たすことがあり,硝酸剤やNO供与薬との併用は禁忌である.
○シルデナフィル
シルデナフィルは最初に発売されたPDE5-I である.初期の臨床試験の後111),112), ランダム化比較試験(SUPER-1)で運動耐容能,NYHA/WHO機能分類の改善および肺血行動態の改善が確認された113).これに加えシルデナフィルは主として換気の良好な肺組織において作用するため,換気血流不均衡の増悪を来たしにくく,低酸素血症の悪化は認められないとされる114),115).ERAと同様にNYHA/WHO分類Ⅱ,Ⅲ度がよい適応とされ,NYHA/WHO分類Ⅳ度にも適応可能である.我が国での保険適応は2008年である.その後発表された長期予後データ(SUPER-2)では,SUPER-1 参加例に対しシルデナフィルを可能な限り240mg/日に増量し,18%の例ではERAまたはプロスタサイクリン経路の薬剤の追加を受けているが,運動耐容能,NYHA/WHO機能分類の改善とともに3年生存が79%であったと報告されている116).
シルデナフィルの投与法は,20mgを1日3回投与である.
○タダラフィル
1日1回投与で治療可能な長時間作用性のPDE5-I である.2009年にIAPH/HPAHを主とするが,他疾患に合併するほぼすべてのPAHを対象としたランダム化比較試験(PHIRST)で運動耐容能,NYHA/WHO機能分類の改善,臨床症状悪化までの期間延長が確認され臨床応用可能となり117),その長期試験(PHIRST-2)でも運動耐容能は保たれていた118). ランダム化比較試験ではNYHA/WHO機能分類Ⅰ度の例も含まれているがESC/ERSガイドラインではNYHA/WHO機能分類Ⅱ,Ⅲ度および,エビデンスレベルは落ちるがNYHA/WHO機能分類Ⅳ度にも適応とされている.またごく小規模ではあるがEisenmenger 症候群を対象としたランダム化比較試験も同様の結果であった119).承認が一番遅く,治療効果のエビデンスはまだ多くない.
投与法は40mgを1 日1回投与である.
③エポプロステノール,ベラプロスト
プロスタグランジンI2( プロスタサイクリン)は1976年に発見されていた血管内皮で産生される生理活性物質で,強力な肺血管拡張作用と血小板凝集抑制作用を有し,さらに血管平滑筋増殖抑制作用を持つと考えられている120). IPAH/HPAHでは血中プロスタサイクリンの減少とトロンボキサンの増加が報告され121),さらにはプロスタサイクリン合成酵素の発現低下122)も存在し,これが本症発症の一因である可能性が示唆されてきた.そこでプロスタサイクリンの投与は本症の基本的な治療手段となり得る可能性が予測された.このプロスタサイクリンを化学合成したものがエポプロステノールである.
IPAH/HPAHの治療薬として臨床応用されているプロスタサイクリン関連薬剤には,持続静注法で用いられるエポプロステノール, 持続皮下注で用いられるtreprostinil,吸入薬のiloprost,経口薬のベラプロストがあるが,我が国ではエポプロステノールとベラプロストのみが使用可能である.
○エポプロステノール
いくつかの多施設共同の臨床試験でエポプロステノールのIPAH/HPAHに対する治療効果が確認されたため123),124),1995年米国食品医薬品局(FDA)がIPAH/HPAHに対する初の治療薬としてエポプロステノールを認可した.1996年,多施設共同の大規模前向きランダム化試験で,運動耐容能,肺循環動態諸量,および生命予後の改善効果が証明され125),本治療法のIPAH/HPAHに対する標準治療法としての位置づけが確定した.急性肺血管拡張効果がみられない症例でもエポプロステノールの慢性投与により病状改善効果が認められるとの報告126)は,本薬剤の血管平滑筋増殖抑制作用などの機序も治療効果につながっている可能性を示唆している.結合組織病に伴うPAHに対しても有効との報告もあり127),現在,PAHに対する内科的治療法としては最も有効性が高い治療法である.肺高血圧症治療薬のランダム化比較試験(観察期間の多くは12~ 16週)についてメタ解析を行った最近の報告でも,PAHの生命予後を改善できる治療薬は,静注のエポプロステノース製剤のみとしている128).
IPAH/HPAHを対象としたエポプロステノール持続静注法の長期予後は,1 年目,2 年目,3年目の生存率はそれぞれ87.8%,76.3%,62.8%(自然歴は58.9%,46.3%,35.4%)と報告されている129).小児IPAH/HPAHでの1年,5年,10年治療成功率は93%,86%,60%であり,他の治療法や移植を併用した生存率は97%,97%,78%である130). また特にNYHA/WHOⅢ ~ Ⅳ 度の重症IPAH/HPAHに限定した検討でも,1 年目,2 年目,3年目,5年目の生存率はそれぞれ85%,70%,63%,55%と改善を示している.ただし治療開始時に右心不全の既往,NYHA/WHOⅣ度,6 分間歩行(250m以下),肺血行動態では右房圧>12mmHg, mean PAP > 65mmHgは長期予後不良を示唆する所見であり,また治療開始3か月後に右心不全NYHAⅢ~Ⅳの持続,総肺血管抵抗値の低下が30%以下も予後不良のサインであり,肺移植登録を考慮すべきである41).
2004年ACCPガイドライン131)では,エポプロステノール投与は1 ~ 2 ng/kg/minの微量から開始し,副作用と容認性を考慮しつつ1~ 2 ng/kg/minずつ徐々に増量するが,通常各々の患者に関しては,それ以上増加の必要性がない投与量が存在すると推定した.この値は個人差は大きいものの,20~ 40 ng/kg/minの間に存在する場合が多く,長期にわたり至適量以上投与している場合には高心拍出性の心不全が生じる可能性を指摘している.一方,我が国では約100 ng/kg/minの高用量エポプロステノールを平均3.7年使用した例では,高心拍出性の心不全を来たすことなく平均肺動脈圧で30%,肺血管抵抗で60%の低下が得られたとの報告があり132),各症例に応じた投与量調節の設定が必要である.重篤な副作用としては,投与量を急速に増やし過ぎた場合に体血圧低下が生じる.軽微な副作用に関しては,投与量の増加に伴い,頭痛,発赤,最初の咀嚼時の下顎痛,下痢,斑状紅斑などがみられるが,通常は増量の一時中止により軽減する.急なエポプロステノールの投与停止はreboundからshock,突然死にいたる可能性があり決して行ってはならない.本剤は経静脈的に持続投与を行う必要があり,投与経路の感染対策や投与量調節など高度の専門性が要求されるので,本治療は肺高血圧症の治療に精通した施設で,熟練した内科医と看護師のもと行われることが推奨される.
○ベラプロスト
ベラプロストは我が国で開発され,1995年より治療に用いられている最初の経口投与可能なプロスタサイクリン誘導体である.我が国では介入研究の成績にて肺血行動態とNYHA/WHO機能分類の改善が報告され133),予後も改善した可能性があることから134),比較的軽症のIPAH/HPAHでは広く処方されている.しかし海外における2つのランダム化比較試験の結果では,6分間歩行距離を指標とした運動耐容能の短期改善効果は認められるが,長期効果は確認されていない135),136).このためベラプロストの推奨度はESC/ERSの肺高血圧症治療ガイドラインでは高くはない.その後,ベラプロスト徐放錠の臨床試験が行われ,短期の運動耐容能と肺血行動態の改善が報告された137).我が国では2007年より徐放錠が処方可能である.
投与法は,180μgを1 日2回投与である.
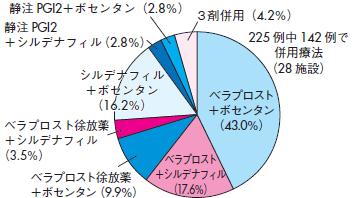
④併用療法
臨床の現場では単剤投与での治療効果の不十分例が少なくない.これらの症例に対して,我が国ではすでに一般的に作用機序の異なる薬剤の併用療法が行われている138)(図6).特異的PAH治療薬の併用療法におけるエビデンスとしては,2種の治療薬の組み合わせを検討したランダム化比較試験の結果が海外では複数報告されている.この中で,我が国で使用可能な薬剤の組み合わせとしては,BREATHE-2試験89)(エポプロステノール╱ボセンタン),PACES試験139)(エポ
プロステノール╱シルデナフィル),COMPASS-1試験140)(ボセンタン╱シルデナフィル),PHIRST試験114) (ボセンタン╱タダラフィル)などがあり,肺血行動態や運動耐容能で併用効果が得られたか,またはその傾向が認められたことが示された.したがって,いずれの系統の治療薬の組み合わせでも一定の併用効果が得られることは期待されるが,これらの試験はそれぞれ観察期間が4か月から6か月で,併用療法が長期生命予後に与える効果については,エビデンスとしては多くはない.
○プロスタサイクリン とPDE5 -Ⅰの併用
エポプロステノール療法中で安定している267例のPAH患者に対してシルデナフィル追加投与群とプラセボ群とを比較したランダム化比較試験(PACES試験)が行われ,シルデナフィル追加投与(4週間20mgを1日3 回,4週間40mgを1 日3回,8 週間80mgを1日3回)群で有意に6 分間歩行距離の延長と臨床的悪化までの期間延長が得られ,併用療法の効果と安全性が示された139).
○ PDE5 -ⅠとERA の併用
ボセンタンを3か月以上継続投与中のPAH患者45例に対し,シルデナフィル25mg単回投与の急性効果をみたCOMPASS-1 試験では,シルデナフィル投与後,有意な平均肺動脈圧と肺血管抵抗の低下,心拍出量の増加がみられ,追加による急性効果が示された140).現在,長期効果についての試験(COMPASS-2 試験)が進められている.ただし,PDE5-I とERAの併用時には代謝酵素CYP3A4とCYP2C9を介した相互作用が指摘されており注意を要する.ボセンタン125mgの1日2回投与とシルデナフィル80mgの1 日3回投与の併用時にはAUC,Cmaxがボセンタンで1.5倍,1.4倍と増加,シルデナフィルで0.37倍,0.45倍と低下した141).ボセンタンとタダラフィルの併用時にはAUC,Cmaxが10日目にタダラフィルで41.5%,26.6%と低下,ボセンタンとその代謝物はともに変化なかった.アンブリセンタンとシルデナフィルあるいはタダラフィルとの相互作用はないとされている.
○プロスタサイクリンとERA の併用
エポプロステノール導入初期33例のPAH患者に対してボセンタン追加投与群とプラセボ群とを比較したランダム化比較試験(BREATHE-2 試験)では,併用群で16週間後に肺血行動態は改善傾向にあったが統計学的な有意差は示されなかった89).ボセンタンと吸入プロスタサイクリン薬の併用療法に関するランダム化比較試験では,効果が得られたSTEP試験142)と効果が得られず症例登録中止したCOMBI 試験があり143),未だ併用効果に関する見解は定まっていない.ただその後2012年に発表されたエポプロステノールとボセンタンを用い重症PAHを対象としてupfront combination therapy では,肺血行動態,NYHA/WHO機能分類,運動耐容能,予後で改善が得られたことが報告されている90).
⑤メタアナリシス
近年,これまで報告された特異的PAH治療薬に対するランダム化比較試験結果のメタアナリシスが行われるようになった.この結果,これまでのランダム化比較試験では個々の治療薬における運動耐容能の改善やNYHA/WHO機能分類度,肺血行動態の改善は認められたが,予後の改善効果に関してはよい結果は得られていなかった.さらに3種類の特異的PAH治療薬間で特に治療効果に差は認められないことが報告されている144)-146).
単剤治療と併用療法に関するメタアナリシスも近年報告されている.これによると選択基準に合致したランダム化比較試験のメタアナリシスでは,併用療法は単剤治療と比較して6MWTで有意な改善がみられ147),また肺血行動態や臨床的悪化までの期間にも改善がみられた148)が死亡率には差がなかったとしている.しかしこれらも観察期間が12~ 16週と短期間のランダム化比較試験の解析から得られた予後結果であり,今後併用療法の長期予後の検討が必要である.
旧来の典型的なIPAH/HPAHの臨床像としては,まず極めて稀な,特に原因と思われる基礎疾患を持たない高度の肺高血圧を主徴とする疾患であることがあげられる.男女比は1:1.7と女性に多く,発症年齢も若年で,妊娠可能年齢の若い女性に好発することも特徴である75).発症頻度は100万人に1~2人と稀な疾患で,治療介入を行わなかった場合,診断からの平均生存期間が2.8年と非常に予後不良で76)あった.しかし最近の検討では小児期にも好発年齢帯が存在し,この時期の発症例では性差はないことも知られてきた.
本症は以前は治療法が皆無であったが,1990年以降に次々と治療薬が開発され,現時点では作用機序の異なる3種類の治療薬が存在し,これらの単剤または組み合わせ治療により生命予後は改善してきた.しかし薬剤抵抗性の例では,適切な時期に肺移植を考慮する必要がある.HPAHはPAHの中では唯一,遺伝子異常が確認され10),11),63),77),78), 遺伝性疾患として認識されたが,IPAHについては発症原因は現在も不明である.
①疫学,成因
1)疫学
我が国では1998年から旧来のPPH( 現在のIPAH/HPAH)が特定疾患治療研究事業対象疾患(いわゆる難病)に指定され,臨床調査個人票による疫学調査が始まった.本調査が我が国では唯一の公的・全国的な疫学情報である.しかしこの登録例にはIPAH/HPAHに加えて他のPAH例が含まれている可能性が高く,厳密な意味では我が国のIPAH/HPAHの症例数とはいえないことが指摘されている.2009年10月より特定疾患治療研究事業対象疾患の「PPH」は世界標準の疾患概念である「PAH」に改訂され,IPAH/HPAHに加え,結合組織病に伴うPAHや先天性心疾患PAHも難病のPAHとして登録可能になった.2011年の統計ではPAH登録証例数は1,969例であり,今後この内容を解析することにより我が国のIPAH/HPAH症例数が明らかになることが期待される.
海外における疫学情報では,米国で行われた最初のPPHに関する症例登録で100万人に1~2人と報告された79).フランスの国家登録作業では2002年に18歳以上のPAHが674例登録され,その中でIPAH/HPAHは290例であった.これより,本症の有病率は4.8人/100万人と計算された12).2006年の米国REVEAL登録研究では2,525例のPAHが登録され,内IPAHは1,166例であった80).
2)成因
HPAHの発症原因として遺伝子異常の存在が確認されている.これまでの報告ではHPAHの 約70 % に,家族歴の確認されていないIPAHと診断された例でも約20 %にBMPR2遺伝子の変異の存在が確認されている10),77).また,本来は遺伝性出血性毛細血管拡張症の原因遺伝子であるACVRL1遺伝子や 小児例では,endoglinの遺伝子異常が発見され81),82),最近では SMAD962),78)や caveolin-1(CAV1)の遺伝子変異63)も報告されている.しかし,遺伝子変異のない例における発症原因は未解決である.PAHの成因に関しては前項(6 肺高血圧症の病因)を参照していただきたい.
②診断方法
IPAH/HPAHの診断手順は総論に記載された方法に準じる.概略すると,診断は肺高血圧の存在診断,肺高血圧症の鑑別診断,および重症度評価の要素から構成されている.IPAH/HPAHは多くの場合,原因不明の労作時呼吸困難か失神発作が初発症状となる.
心電図,胸部X線写真から肺高血圧の存在が疑われた場合,心エコー・ドプラ法により肺高血圧の確定と半定量評価を行う.同時に他の心肺疾患の存在を検索する.合併疾患が存在せず固定した肺高血圧が存在すれば,第1群のPAHか第4群のCTEPHの可能性が高いと判断される.この両者の鑑別には肺換気─血流シンチグラムが極めて有効であるが,造影CTで鑑別が可能な場合もある.これら検査結果の解釈は容易でない場合も多く,正確な診断は経験のある専門施設で行われることが望ましい.
PAHである可能性が高いと診断された場合には,CTD-PAHやPOPH,CHD-PAH,PVOD/PCHを血液検査や画像検査で除外しつつ,右心カテーテルで肺血行動態を測定して確定診断,重症度評価を行う.運動耐容能などの評価も治療方針決定に有用である.IPAHとHPAHの鑑別は,一般診療の場では詳細な病歴聴取を行う以外に方法はない.遺伝子診断に関しては,検査が可能な施設は我が国では数か所存在し,確定診断も可能である.ただし,遺伝子検査は必須でもなく,また強制するべき検査でもない.表7には2010年に改訂された厚労省難治性疾患克服研究事業で定められたPAHの診断基準を示す.
③予後・重症度評価
1)予後
IPAH/HPAH の自然歴は極めて不良で,旧来の報告では,発症後の平均生存期間は成人例未治療の場合 2.8年で,死因は突然死,右心不全,喀血が多いとされていた76).小児の未治療IPAH/HPAH の予後は成人に比較してさらに不良で,平均生存期間が10か月であると報告されている76).
我が国ではIPAH/HPAHの自然予後に関する全国規模でのデータは存在しない.単施設の結果ではあるが,治療薬が存在しなかった時期の自験例(国立循環器病研究センター)198例の調査の結果では,1年生存率,3 年生存率,5年生存率が各々67.9%,40.2%,38.1%であり,海外例との間に予後に大きな差異は認めらなかった83).近年の欧米における大規模症例登録の解析結果では,本症の予後は改善してきており,フランスの報告ではIPAH/HPAH/薬剤性PAHの1 年生存率,3年生存率,5年生存率が各々89%,77%,69% 84),米国REVEAL登録研究ではIPAH/HPAHの1年生存率 ,3年生存率,5年生存率,7年生存率はそれぞれ 91%, 74%, 65%,59%であった85).これは最近の特異的PAH治療薬の開発に負うところが大と考えられる.
2)重症度/予後評価
以前のIPAH/HPAH の重症度/予後評価では,肺血行動態上の諸指標が重視され,これより予後を算出する計算式も提案されていた76).しかし現在では病状の進行度や失神, 右心不全の既往などの臨床症状の有無,NYHA/WHO肺高血圧症機能分類度,運動負荷試験(6分間歩行試験・心肺運動負荷試験)40),44),心エコー法で心嚢液の有無,TAPSE 31)などの生理学的指標や,BNP 23),血中尿酸値27)などのバイオマーカー値などを総合して重症度評価や治療効果判定を行うことが主流となってきている.ESC/ERSのガイドラインでは表8が重症度/予後と治療方針を決定するための参考にされ,病状を予後がよい指標とされる項目を多く含む順に「安定し,満足している」,「安定しているが,十分でない」,「不安定で,悪化してる」と分類し,治療方針決定に用いている3).また最近の米国のREVEAL症例登録研究からは,新たにPAHの予後についてのリスク スコアー計算法も発表されている86).これらの評価では,肺循環動態諸指標に関しては,肺動脈圧自身よりむしろ右房圧や心拍出量係数,肺血管抵抗が重視され,混合静脈血酸素飽和度(Svo2)も重症度評価には有用である.
④ IPAH/HPAH の内科治療
IPAH/HPAHに対する内科的治療法は近年飛躍的に発展した.現在我が国ではプロスタサイクリン経路に属するプロスタサイクリンとその誘導体,エンドセリン経路に属するエンドセリン受容体拮抗薬(endothelin receptor antagonist: ERA),および一酸化窒素(NO)経路に属するホスホジエステラーゼ5阻害薬(phosphodiesterase type-5 inhibitor: PDE5-I)のそれぞれ異なった3系統の特異的PAH治療薬が存在する.
欧米ではこれらの薬剤が認可される際,および市販後にも特異的PAH治療薬の治療効果について多くの臨床試験が行われ,種々のエビデンスが集積されてきた.そこで2008年のダナポイント会議では,当時の治療エビデンスを集約したPAH治療ガイドラインの作成が試みられ,2009年にはこれを成文化したPAH治療ガイドラインが Journal of the American College of Cardiology 誌(JACC)1)に発表された.またこの内容をより具体化したESC/ERS肺高血圧症治療ガイドライン3)がEuropean Heart Journal誌に掲載され,ほぼ同内容のERSガイドライン4)もEuropean Respiratory Journal 誌に掲載されている.しかし我が国では肺高血圧症治療薬の大規模な臨床試験はなく,日本人に関するエビデンスにより独自のPAH治療ガイドラインを作成することは困難である.このため本日本循環器学会ガイドラインはJACCおよびESCやERSのPAHガイドライン,および2013年2月のニース会議の発表内容を基本とし,我が国では発売されていない治療薬は除いて作成した.
1)IPAH/HPAH の治療指針概略(図5)
IPAH/HPAHの治療指針は,まずIPAH/HPAHの確定診断と重症度評価を行いつつ,以下の一般的対応/支持療法を開始する(表9,表10).PAHでは基本的にはワルファリンを用いて抗凝固療法を行う.低酸素血症があれば酸素投与の適応と考えられ,我が国では肺高血圧症の診断で在宅酸素療法の健康保険の適応が得られている.右心不全症状があれば利尿薬の投与や,心房性頻拍症があればジゴキシンを用いる場合もある.妊娠は禁忌とされ,感染症予防の目的でインフルエンザや肺炎球菌の予防接種が勧められている.
これらの支持療法を行いつつ,IPAH/HPAHについてはまずNO吸入かエポプロステノール静注法を用いた急性肺血管反応性試験を行うことが推奨される.急性肺血管反応性試験の詳細は「肺高血圧症の診断」の項を参照されたい.肺血管反応性が陽性の症例についてはカルシウムチャンネル拮抗薬(CCB) 療法が推奨される.CCB治療開始後にNYHA/WHO機能分類のⅡ度またはⅠ度に改善すれば本治療を続行する.
急性肺血管反応性試験の陰性例,またはCCB治療を行っても症状の改善がみられない例については特異的PAH治療薬を速やかに開始する.特異的PAH治療薬には前述のように3系統の治療薬が存在し,そのいずれかを用いて治療を開始するが,NYHA/WHO機能分類の観点からⅡ度・Ⅲ度例に対しては,ERA,PDE5-I の薬剤は適応とするエビデンスがある.またNYHA/WHO機能分類Ⅲ度例の中でも特に「症状の進行速度など」他の重症度指標で予後不良の項目が多い重症例ではエポプロステノールの適応を考慮する.NYHA/WHO機能分類Ⅳ度例はエポプロステノールの適応である.
単剤で十分な治療効果が得られない場合,現在は2剤,3剤の併用療法が行われている.特異的PAH治療薬の各々については有効性を示すエビデンスの蓄積はある.しかしこれら薬剤の併用療法については組み合わせ方や順番,注意点についての情報は少なく,詳細は分かっていない.しかし「異なる作用機序をもつ治療薬の併用療法」という治療方針は,多くの専門家の合意は得られており,また有効であるとのエビデンスも蓄積しつつある.
PAHに対する併用療法には,特定の治療到達目標を定め,その目標に到達するように逐次PAH治療薬を追加してゆく目標指向型治療(goal-oriented therapy)(treat-totarget therapy)である sequential combination therapyと,特に具体的な治療目標を設定せず治療初期から複数の治療薬をほぼ時間差なく併用開始するupfront combination therapy/ upfront triple combination therapyがある.さらに目標指向型治療では治療目標を一定の運動耐容能に設定する方法や88),運動耐容能に加えて予後不良とされるax複数の重症度指標を設定し,これを減じるように投薬を追加する方法がある.目標指向型治療法を実践した最初の研究では,ボセンタンを初期治療薬として用い,シルデナフィル,iloprost(吸入,静注)を必要に応じて逐次追加することで3年生存率は79.9%と有意に延長したと報告されている88).
2009年のESC/ERSの肺高血圧治療ガイドラインでは,治療対象例の重症度を表8に示す各項目について評価し,まず任意の特異的PAH治療薬を単剤で開始する.治療は重症度指標の各項目について3~ 6か月ごとに評価を行い,病状が治療目標を満足していない場合,逐次治療薬を追加する3),4).しかし,具体的な治療薬の選択法についての言及は行われていない.右心カテーテルは治療開始,治療変更の3~ 4か月後,および臨床的増悪が認められた場合に施行することを推奨している.
Upfront combination therapy に関しては,我が国でも多くの専門家が有用であると考え,すでに実際に行われている場合も多い.しかし,いわゆるエビデンスとしては,論文報告は少なく,既存の報告としてはNYHA/WHO機能分類のⅢ~Ⅳ度の重症例を対象にボセンタンとエポプロステノールを併用した upfront therapyの結果がある程度である89),90).現在,欧州ではYHA/WHO機能分類のⅡ~Ⅲ度例についての有効性や,治療薬の組み合わせ(2剤,3剤併用を含む)につき治験が進行中である.upfront combination therapyの具体的な手順も,今後の検討課題である.
近年「IPAH/HPAHの治療目標をいかに設定するか?」に関して様々な議論が行われている.ESC/ERSのガイドラインなど欧米では予後決定因子を総合的に評価し「安定し,満足している」を治療目標とし,これを達成することが予後の改善につながると考え91),肺血行動態の正常化に関しては,これを絶対目標とはしていない場合が多い.一方,我が国では治療目標はあくまで肺血行動態の正常化を目指すべきであり,このために治療薬の増量・併用を積極的に勧めるとの考え方がある.ただしIPAH/HPAHでは,積極的治療により肺血行動態の正常化が達成される例もあるがEisenmenger 症候群などのCHD-PAHでは肺血行動態の正常化は極めて困難な場合が多い.同じ第1群に属していても各PAHで治療に対する反応性は大きく異なっている可能性がある.各PAH疾患の特性を把握し,治療目標を設定する作業は,現時点では各々の担当医の判断に委ねられており,そのためにも治療方針決定は十分な経験を持った施設で行われることが必要である.
内科的治療法に反応しない例は心房中隔裂開術や肺移植の適応とされている.しかし我が国では心房中隔裂開術の報告はほとんどなくガイドラインには採用しなかった.一方,IPAH/HPAHに対する肺移植は近年ようやく現実の治療法となってきたが,未だ実施例は多くはない.
以上IPAH/HPAHの治療指針について概略した.本指針を臨床の場で参考にする場合の注意点としては,まず本項の記載内容は第1群PAHのみを対象としたものであり,第2 群~4群肺高血圧症の治療指針とはならないことに留意する.さらに,ここに記載した多くの臨床試験は,第1 群PAHでも主としてIPAH/HPAHが対象患者となり,CTD-PAHやCHD-PAHなど例の参加は多くはない. 近年同じPAHに属していても,IPAH/HPAH,CTD-PAH,CHD-PAHなど各々は病因・病態や臨床像,生命予後は大きく異なっていることが報告されてきている92).したがってIPAH/HPAHに対する治療指針がすべてのPAHに同一に適応される訳ではなく,各PAHに対する治療は各々の病態に応じて工夫する必要がある.
2)抗凝固療法
IPAH/HPAHおよび食欲減退薬によるPAHを対象とした3つの後ろ向き研究で,ワルファリンにより生命予後が改善されることが示されている93)-95).ワルファリンの用量は,PT-INRを1.5~ 2.5を目標とする場合が多い.しかし,これらの成績はすべてエポプロステノールが使用できない時代のものである.エポプロステノール持続静注法では,カテーテル由来の血栓を起こす可能性があるが,一方で強力な抗血小板凝集抑制作用による出血性の合併症も考えなければならない.Ogawa らはエポプロステノールと抗凝固療法の併用により肺胞出血の危険性が高くなる可能性を指摘している96).他の疾患に伴うPAHでは,出血性合併症(門脈─肺高血圧症の消化管出血や先天性心疾患における奇異性塞栓や肺胞出血の頻度など)の多寡により投与の有無や用量を決める.
3)利尿薬
右心不全により水分貯留が起こり,そのコントロールのために用いられる.ループ利尿薬,サイアザイド系利尿薬,抗アルドステロン薬を単独あるいは併用する.使用に際しては,電解質異常や過度の血管内脱水による低血圧の発生,低心拍出の進行に十分注意を払う.
4)長期酸素療法(在宅酸素療法)
酸素吸入はPAH例において平均肺動脈圧と肺血管抵抗を低下させる急性効果を有している97),98).一般に,慢性閉塞性肺疾患で証明されたと同様の生命予後改善を期待して,動脈血酸素分圧を60mmHg以上に保つ酸素投与が行われている.しかし,CHD-PAHを対象とした唯一の無作為割付試験では,2年間の酸素療法では死亡率の改善は示されなかったとの報告もある99).
5)ジギタリス製剤
ジギタリス製剤は動物実験では弱い肺血管収縮作用が示されている100).肺高血圧患者に対する急性効果では心拍出量は増加し,肺血管抵抗は不変であった101).しかし,慢性効果については明らかでなく,心拍コントロールの際に考慮すべき薬剤として位置づけられている.
6)その他の強心薬
重症右心不全の治療,あるいは肺血管拡張薬の導入時にカテコラミンを利用する場合がある.体血圧が比較的保たれている場合にはドブタミンが選択されるが,保たれない場合にはドパミン単独あるいはドブタミンと併用する.カテコラミンからの離脱にはピモベンダン,ドカルパミン,デノパミンなどの経口心不全治療薬が必要なこともある.
7) カルシウムチャンネル拮抗薬(calcium channel blocker: CCB)
現在の特異的PAH治療薬が臨床応用開始される以前の1992年に,Richらは,急性肺血管反応性試験で反応例については高用量のCCBを投与して予後が改善することを初めて示した93).ただしCCBが著効する症例の割合は低く,また長期的に有効性が維持されるのは急性肺血管反応性試験の陽性例の半数に過ぎず37),反応例は若年者で多いことが知られている102).CCBが有効な例はIPAH/HPAHに限定される可能性も指摘されており,本治療薬の適応は極めて限られる.また急性肺血管反応性試験もそれ自体常に一定の危険性が存在し,肺高血圧症の治療に精通した専門施設でのみ実施されることが強く推奨されている.
使用される薬剤としてはニフェジピン,ジルチアゼム,アムロジピンが一般的である.欧米ではニフェジピンの120~ 240mg,ジルチアゼムの240~ 720mgの高用量が用いられているが,我が国ではこの使用量は困難で,最小量より開始し適正量を見つけることが肝要である.
8)特異的PAH 治療薬
PAHの病態は,発症初期には高度の肺動脈攣縮が生じ,その後これに器質化病変が加わり,肺高血圧症が固定化すると考えられている.近年,肺血管に選択性の高い3系統の血管拡張薬,すなわちプロスタサイクリン経路,エンドセリン経路,一酸化窒素(NO)経路の薬剤が開発され,本症に対する内科治療が本格的に開始されている.
① エンドセリン受容体拮抗薬(endothelin receptor antagonist: ERA)
ERAにはエンドセリンAおよびB受容体の両者に対する拮抗薬であるボセンタンと,エンドセリンA受容体に選択性が高いアンブリセンタンがある.平滑筋細胞に存在するエンドセリンA受容体への刺激は血管平滑筋収縮と増殖,炎症・線維化を誘導・促進する.一方,エンドセリンB受容体は正常では主に血管内皮細胞に存在し,刺激により一酸化窒素やプロスタサイクリン産生を亢進することで血管を拡張させる.しかし肺高血圧症例においてエンドセリンB受容体は血管内皮細胞では減少,平滑筋細胞では増加する.それゆえ,肺高血圧治療にエンドセリンA受容体に選択性の高い薬剤と選択性のない薬剤に優劣があるのかについては議論がある.
○ボセンタン
エンドセリン受容体拮抗薬としては最初の経口薬剤で,2005年に日本でも処方可能となった.主なランダム化比較試験には対象の90%がNYHA/WHO機能分類
ⅢのIPAHまたはSSCに伴うPAHであったBREATHE-1 103),先天性心疾患に由来するPAHを対象としたBREATHE-5 104),NYHA/WHO機能分類Ⅱを対象とし
たEARLY試験105)がある.BREATHE-1,BREATHE-5,EARLY試験では,それぞれ16週間,16週間,6か月でのボセンタンによる6 分間歩行距離の改善が確認
された.また,ボセンタンを第一選択薬とした際の長期生命予後はNIH登録の予測式から計算された予後より改善することが示された106),107).有害事象としては血清トランスアミナーゼ上昇が10%未満に出現する.この肝機能異常は用量依存性であり,中断や減量で改善する.定期的な肝機能検査が必要である.ESC/ERSガイドラインではNYHA/WHO機能分類Ⅱ,Ⅲ度がボセンタンのよい適応で,Ⅳ度例への投与のエビデンスレベルはやや低下する.我が国でも同様の対応としてよい.
ボセンタンの投与法は,投与開始後4週間は62.5mgを1日2回,5週目より125mgを必要に応じて1 日2回投与する.
○アンブリセンタン
アンブリセンタンの最初の臨床試験結果は2005年に発表され108),その後のNYHA/WHOⅠ~Ⅳ度のIPAH/HPAH,CTD-PAHを対象とした2 つのランダム化比較試験(ARIES-1,ARIES-2)で治療期間12週間後に6分間歩行距離の改善が確認され109),それに続く2 年の長期投与でも運動能が保たれていた110).試験は1日投与量が2.5mg,5mg,10mgの3 群で実施されたが,全症例をプールした解析では1年生存率が94%,2 年生存率が88%であった.また,血清トランスアミナーゼが正常上限の3 倍を超える上昇は年間2%以下とされるが109),末梢浮腫の発現が報告されている.我が国での採用は2010年である.
アンブリセンタンの投与法は,5mgを1日1回,その後必要に応じて10mgを1日1回投与する.
② ホスホジエステラーゼ5 阻害薬(phosphodiesterase type-5 inhibitor: PDE5-I)
PDE5 は肺組織,特に肺血管平滑筋細胞に豊富に存在し,血管拡張作用を有するcGMPを特異的に加水分解する.PDE5-I はこのPDE5 を阻害することで,肺動脈血管平滑筋を弛緩させる.現在,我が国でPAH治療に承認されているPDE5-I としてはシルデナフィルとタダラフィルが存在し,両剤ともに経口薬である.肺血管選択性があるが,過度の体血圧低下を来たすことがあり,硝酸剤やNO供与薬との併用は禁忌である.
○シルデナフィル
シルデナフィルは最初に発売されたPDE5-I である.初期の臨床試験の後111),112), ランダム化比較試験(SUPER-1)で運動耐容能,NYHA/WHO機能分類の改善および肺血行動態の改善が確認された113).これに加えシルデナフィルは主として換気の良好な肺組織において作用するため,換気血流不均衡の増悪を来たしにくく,低酸素血症の悪化は認められないとされる114),115).ERAと同様にNYHA/WHO分類Ⅱ,Ⅲ度がよい適応とされ,NYHA/WHO分類Ⅳ度にも適応可能である.我が国での保険適応は2008年である.その後発表された長期予後データ(SUPER-2)では,SUPER-1 参加例に対しシルデナフィルを可能な限り240mg/日に増量し,18%の例ではERAまたはプロスタサイクリン経路の薬剤の追加を受けているが,運動耐容能,NYHA/WHO機能分類の改善とともに3年生存が79%であったと報告されている116).
シルデナフィルの投与法は,20mgを1日3回投与である.
○タダラフィル
1日1回投与で治療可能な長時間作用性のPDE5-I である.2009年にIAPH/HPAHを主とするが,他疾患に合併するほぼすべてのPAHを対象としたランダム化比較試験(PHIRST)で運動耐容能,NYHA/WHO機能分類の改善,臨床症状悪化までの期間延長が確認され臨床応用可能となり117),その長期試験(PHIRST-2)でも運動耐容能は保たれていた118). ランダム化比較試験ではNYHA/WHO機能分類Ⅰ度の例も含まれているがESC/ERSガイドラインではNYHA/WHO機能分類Ⅱ,Ⅲ度および,エビデンスレベルは落ちるがNYHA/WHO機能分類Ⅳ度にも適応とされている.またごく小規模ではあるがEisenmenger 症候群を対象としたランダム化比較試験も同様の結果であった119).承認が一番遅く,治療効果のエビデンスはまだ多くない.
投与法は40mgを1 日1回投与である.
③エポプロステノール,ベラプロスト
プロスタグランジンI2( プロスタサイクリン)は1976年に発見されていた血管内皮で産生される生理活性物質で,強力な肺血管拡張作用と血小板凝集抑制作用を有し,さらに血管平滑筋増殖抑制作用を持つと考えられている120). IPAH/HPAHでは血中プロスタサイクリンの減少とトロンボキサンの増加が報告され121),さらにはプロスタサイクリン合成酵素の発現低下122)も存在し,これが本症発症の一因である可能性が示唆されてきた.そこでプロスタサイクリンの投与は本症の基本的な治療手段となり得る可能性が予測された.このプロスタサイクリンを化学合成したものがエポプロステノールである.
IPAH/HPAHの治療薬として臨床応用されているプロスタサイクリン関連薬剤には,持続静注法で用いられるエポプロステノール, 持続皮下注で用いられるtreprostinil,吸入薬のiloprost,経口薬のベラプロストがあるが,我が国ではエポプロステノールとベラプロストのみが使用可能である.
○エポプロステノール
いくつかの多施設共同の臨床試験でエポプロステノールのIPAH/HPAHに対する治療効果が確認されたため123),124),1995年米国食品医薬品局(FDA)がIPAH/HPAHに対する初の治療薬としてエポプロステノールを認可した.1996年,多施設共同の大規模前向きランダム化試験で,運動耐容能,肺循環動態諸量,および生命予後の改善効果が証明され125),本治療法のIPAH/HPAHに対する標準治療法としての位置づけが確定した.急性肺血管拡張効果がみられない症例でもエポプロステノールの慢性投与により病状改善効果が認められるとの報告126)は,本薬剤の血管平滑筋増殖抑制作用などの機序も治療効果につながっている可能性を示唆している.結合組織病に伴うPAHに対しても有効との報告もあり127),現在,PAHに対する内科的治療法としては最も有効性が高い治療法である.肺高血圧症治療薬のランダム化比較試験(観察期間の多くは12~ 16週)についてメタ解析を行った最近の報告でも,PAHの生命予後を改善できる治療薬は,静注のエポプロステノース製剤のみとしている128).
IPAH/HPAHを対象としたエポプロステノール持続静注法の長期予後は,1 年目,2 年目,3年目の生存率はそれぞれ87.8%,76.3%,62.8%(自然歴は58.9%,46.3%,35.4%)と報告されている129).小児IPAH/HPAHでの1年,5年,10年治療成功率は93%,86%,60%であり,他の治療法や移植を併用した生存率は97%,97%,78%である130). また特にNYHA/WHOⅢ ~ Ⅳ 度の重症IPAH/HPAHに限定した検討でも,1 年目,2 年目,3年目,5年目の生存率はそれぞれ85%,70%,63%,55%と改善を示している.ただし治療開始時に右心不全の既往,NYHA/WHOⅣ度,6 分間歩行(250m以下),肺血行動態では右房圧>12mmHg, mean PAP > 65mmHgは長期予後不良を示唆する所見であり,また治療開始3か月後に右心不全NYHAⅢ~Ⅳの持続,総肺血管抵抗値の低下が30%以下も予後不良のサインであり,肺移植登録を考慮すべきである41).
2004年ACCPガイドライン131)では,エポプロステノール投与は1 ~ 2 ng/kg/minの微量から開始し,副作用と容認性を考慮しつつ1~ 2 ng/kg/minずつ徐々に増量するが,通常各々の患者に関しては,それ以上増加の必要性がない投与量が存在すると推定した.この値は個人差は大きいものの,20~ 40 ng/kg/minの間に存在する場合が多く,長期にわたり至適量以上投与している場合には高心拍出性の心不全が生じる可能性を指摘している.一方,我が国では約100 ng/kg/minの高用量エポプロステノールを平均3.7年使用した例では,高心拍出性の心不全を来たすことなく平均肺動脈圧で30%,肺血管抵抗で60%の低下が得られたとの報告があり132),各症例に応じた投与量調節の設定が必要である.重篤な副作用としては,投与量を急速に増やし過ぎた場合に体血圧低下が生じる.軽微な副作用に関しては,投与量の増加に伴い,頭痛,発赤,最初の咀嚼時の下顎痛,下痢,斑状紅斑などがみられるが,通常は増量の一時中止により軽減する.急なエポプロステノールの投与停止はreboundからshock,突然死にいたる可能性があり決して行ってはならない.本剤は経静脈的に持続投与を行う必要があり,投与経路の感染対策や投与量調節など高度の専門性が要求されるので,本治療は肺高血圧症の治療に精通した施設で,熟練した内科医と看護師のもと行われることが推奨される.
○ベラプロスト
ベラプロストは我が国で開発され,1995年より治療に用いられている最初の経口投与可能なプロスタサイクリン誘導体である.我が国では介入研究の成績にて肺血行動態とNYHA/WHO機能分類の改善が報告され133),予後も改善した可能性があることから134),比較的軽症のIPAH/HPAHでは広く処方されている.しかし海外における2つのランダム化比較試験の結果では,6分間歩行距離を指標とした運動耐容能の短期改善効果は認められるが,長期効果は確認されていない135),136).このためベラプロストの推奨度はESC/ERSの肺高血圧症治療ガイドラインでは高くはない.その後,ベラプロスト徐放錠の臨床試験が行われ,短期の運動耐容能と肺血行動態の改善が報告された137).我が国では2007年より徐放錠が処方可能である.
投与法は,180μgを1 日2回投与である.
④併用療法
臨床の現場では単剤投与での治療効果の不十分例が少なくない.これらの症例に対して,我が国ではすでに一般的に作用機序の異なる薬剤の併用療法が行われている138)(図6).特異的PAH治療薬の併用療法におけるエビデンスとしては,2種の治療薬の組み合わせを検討したランダム化比較試験の結果が海外では複数報告されている.この中で,我が国で使用可能な薬剤の組み合わせとしては,BREATHE-2試験89)(エポプロステノール╱ボセンタン),PACES試験139)(エポ
プロステノール╱シルデナフィル),COMPASS-1試験140)(ボセンタン╱シルデナフィル),PHIRST試験114) (ボセンタン╱タダラフィル)などがあり,肺血行動態や運動耐容能で併用効果が得られたか,またはその傾向が認められたことが示された.したがって,いずれの系統の治療薬の組み合わせでも一定の併用効果が得られることは期待されるが,これらの試験はそれぞれ観察期間が4か月から6か月で,併用療法が長期生命予後に与える効果については,エビデンスとしては多くはない.
○プロスタサイクリン とPDE5 -Ⅰの併用
エポプロステノール療法中で安定している267例のPAH患者に対してシルデナフィル追加投与群とプラセボ群とを比較したランダム化比較試験(PACES試験)が行われ,シルデナフィル追加投与(4週間20mgを1日3 回,4週間40mgを1 日3回,8 週間80mgを1日3回)群で有意に6 分間歩行距離の延長と臨床的悪化までの期間延長が得られ,併用療法の効果と安全性が示された139).
○ PDE5 -ⅠとERA の併用
ボセンタンを3か月以上継続投与中のPAH患者45例に対し,シルデナフィル25mg単回投与の急性効果をみたCOMPASS-1 試験では,シルデナフィル投与後,有意な平均肺動脈圧と肺血管抵抗の低下,心拍出量の増加がみられ,追加による急性効果が示された140).現在,長期効果についての試験(COMPASS-2 試験)が進められている.ただし,PDE5-I とERAの併用時には代謝酵素CYP3A4とCYP2C9を介した相互作用が指摘されており注意を要する.ボセンタン125mgの1日2回投与とシルデナフィル80mgの1 日3回投与の併用時にはAUC,Cmaxがボセンタンで1.5倍,1.4倍と増加,シルデナフィルで0.37倍,0.45倍と低下した141).ボセンタンとタダラフィルの併用時にはAUC,Cmaxが10日目にタダラフィルで41.5%,26.6%と低下,ボセンタンとその代謝物はともに変化なかった.アンブリセンタンとシルデナフィルあるいはタダラフィルとの相互作用はないとされている.
○プロスタサイクリンとERA の併用
エポプロステノール導入初期33例のPAH患者に対してボセンタン追加投与群とプラセボ群とを比較したランダム化比較試験(BREATHE-2 試験)では,併用群で16週間後に肺血行動態は改善傾向にあったが統計学的な有意差は示されなかった89).ボセンタンと吸入プロスタサイクリン薬の併用療法に関するランダム化比較試験では,効果が得られたSTEP試験142)と効果が得られず症例登録中止したCOMBI 試験があり143),未だ併用効果に関する見解は定まっていない.ただその後2012年に発表されたエポプロステノールとボセンタンを用い重症PAHを対象としてupfront combination therapy では,肺血行動態,NYHA/WHO機能分類,運動耐容能,予後で改善が得られたことが報告されている90).
⑤メタアナリシス
近年,これまで報告された特異的PAH治療薬に対するランダム化比較試験結果のメタアナリシスが行われるようになった.この結果,これまでのランダム化比較試験では個々の治療薬における運動耐容能の改善やNYHA/WHO機能分類度,肺血行動態の改善は認められたが,予後の改善効果に関してはよい結果は得られていなかった.さらに3種類の特異的PAH治療薬間で特に治療効果に差は認められないことが報告されている144)-146).
単剤治療と併用療法に関するメタアナリシスも近年報告されている.これによると選択基準に合致したランダム化比較試験のメタアナリシスでは,併用療法は単剤治療と比較して6MWTで有意な改善がみられ147),また肺血行動態や臨床的悪化までの期間にも改善がみられた148)が死亡率には差がなかったとしている.しかしこれらも観察期間が12~ 16週と短期間のランダム化比較試験の解析から得られた予後結果であり,今後併用療法の長期予後の検討が必要である.
1 特発性肺動脈性肺高血圧症(IPAH)/ 遺伝性肺動脈性肺高血圧症(HPAH)
表7 肺動脈性肺高血圧症の診断基準
表8 肺動脈性肺高血圧症の重症度/予後評価
文献87より,引用,一部改変
CPX: 心肺運動負荷試験
CPX: 心肺運動負荷試験
図5 肺動脈性肺高血圧症に対する治療手順
表9 肺動脈性肺高血圧症に対する一般対応
表10 特発性PAH/遺伝性PAHに対する支持療法
図6 我が国における併用療法の現状(2009年)
文献138より引用
Ⅱ 各論 >
1 肺動脈性肺高血圧症(PAH) >
1 特発性肺動脈性肺高血圧症(IPAH)/ 遺伝性肺動脈性肺高血圧症(HPAH)